O ácido sulfúrico é um composto inorgânico, de função ácida, pois contém em sua estrutura hidrogênios ionizáveis e carga positiva cátion H+. Em outras palavras, é um ácido altamente corrosivo. Esse ácido também é conhecido popularmente como ácido de bateria ou óleo de vitriolo.
Estamos falando de uma solução aquosa de sulfato de hidrogênio, representado pela fórmula H2SO4. O ácido sulfúrico, portanto, é uma substância essencial para a indústria, tanto que é usada como indicador de potência industrial.
Portanto, hoje iremos conhecer tudo sobre o ácido sulfúrico, suas características e utilidades.
Características do ácido sulfúrico
Para começar, devemos estar cientes de que se trata de um ácido altamente tóxico e corrosivo. Isso porque o ácido sulfúrico tem ação oxidante e desidratante muito forte. Ou seja, é capaz de carbonizar compostos orgânicos.
Essa substância é obtida a partir de enxofre, oxigênio e água, por meio de um processo de contato. Assim, ele é comercializado com pureza altíssima de 97%, o que faz com que sua evaporação seja muito lenta em temperatura ambiente.
Solúvel em solventes polares, o seu grau de ionização é muito alto, o que faz com ele que seja um ácido muito forte. Quando solúvel em água, ocorre uma reação exotérmica, portanto, liberando muito calor.
Sendo assim, ao manusear essa substância, é preciso tomar alguns cuidados. Em hipótese alguma despeje água sobre o ácido sulfúrico, o correto é fazer o processo inverso. Já que ao ser adicionado na água, a liberação de calor é minimizada.
Por isso, o ácido sulfúrico pode causar muitos problemas aos seres humanos, caso seja ingerido acidentalmente, inalado ou entre em contato direto com a pele.

Fórmula do ácido sulfúrico
Não se sabe ao certo quem é o verdadeiro descobridor desse ácido, mas acredita-se que foi o alquimista muçulmano Jabir Ibn Hayyan. Essa substância foi batizada inicialmente de Zayt al-Zaj, ou óleo de vitríolo.
Quanto à sua composição, o ácido sulfúrico é formado por dois átomos de hidrogênio, um de enxofre e quatro de oxigênio. Assim, formando a fórmula molecular H2SO4. No quesito ligações moleculares, todas são do tipo covalente polar.
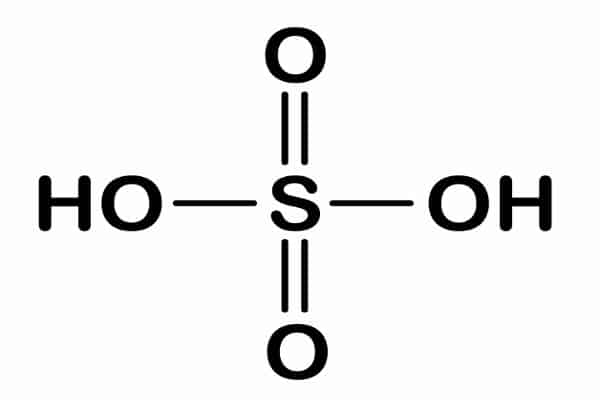
Fonte: Brasil Escola
Da mesma forma que acontece com outros tipos de ácido, o sulfúrico também é solúvel em água, o que faz com que ele libere íon H+.
Vejamos um exemplo de reação: H2SO4(aq) → 2 H+(aq) + SO42-(aq)
Portanto, para mensurar a força dos oxiácidos que contém oxigênio em sua estrutura, é preciso fazer a subtração do número de hidrogênios ionizáveis do número de oxigênios presentes na molécula. Sendo assim, se o resultado for um número igual ou maior que dois, significa que temos um ácido forte; caso o resultado seja 1, o ácido é moderado, e se for menor que 1, temos um ácido fraco.
Desse modo, no caso do ácido sulfúrico, temos a seguinte subtração:
(Número de átomos de O – Número de átomos de H)
(4-2=2)
Assim, o resultado é igual a 2. Portanto, um ácido considerado forte.
Para que serve o ácido sulfúrico?
Como disto anteriormente, o ácido sulfúrico é amplamente utilizado nas indústrias. Desse modo, uma das principais aplicações desse ácido é como solução de baterias usadas automóveis. Nesse caso, a concentração de ácido sulfúrico nessas baterias é de 30%, assim, a medição da sua densidade revela se a bateria precisa ser carregada ou não.
Essa substância também é comumente usada nas indústrias petroquímicas para o refino de petróleo, e como decapante de ferro e aço. E também é usada na produção de fertilizantes e até no tratamento de água.
Mas, além disso, também tem utilização na produção de papel e na limpeza industrial, servindo como removedor de oxidação e ferrugem.
Sendo assim, veremos a principal forma de obtenção de ácido sulfúrico pela indústria, feita em três etapas:
- 1ª. Obtenção do dióxido de enxofre (SO2(g))
- 2ª. Obtenção do trióxido de enxofre (SO3(g))
- 3ª. Produção de ácido sulfúrico pela reação entre o trióxido de enxofre e água.

Fonte: Segurança e Telecom
Perigos
Conforme visto acima, o ácido sulfúrico tem alto poder de corrosivo e desidratante, o que faz dele um dos ácidos mais perigosos existentes.
Por ser capaz de carbonizar compostos orgânicos, em contato com a pele, essa substância pode provocar queimaduras graves. Essa reação de desidratação ocorre porque o ácido decompõe proteínas, carboidratos e lipídios presentes na pele e nos músculos.
Desse modo, os vapores liberados pelo ácido também são nocivos, principalmente quando inalados em grande quantidade. Isso pode provocar muita irritação nos olhos e até nas vias respiratórios.
Por isso, a necessidade de manusear com cuidado esse ácido. Assim, a melhor forma de armazená-lo é em recipiente de vidro, com rótulo explicitando a sua concentração.

Fonte: Canal Área Secreta
Curiosidade
A chuva ácida, conhecida por destruir construções e degradar o meio ambiente, tem como principal ativo o ácido sulfúrico. Isso ocorre porque os combustíveis fósseis, dentre eles o carvão e derivados do petróleo, possuem alto teor de enxofre em suas composições.
Então, quando são carbonizados para gerar energia, eles liberam na atmosfera dióxido de enxofre. Assim, esse óxido reage em contato com a água da chuva e origina o ácido sulfúrico, que como vimos aqui, é um ácido muito forte e tóxico.
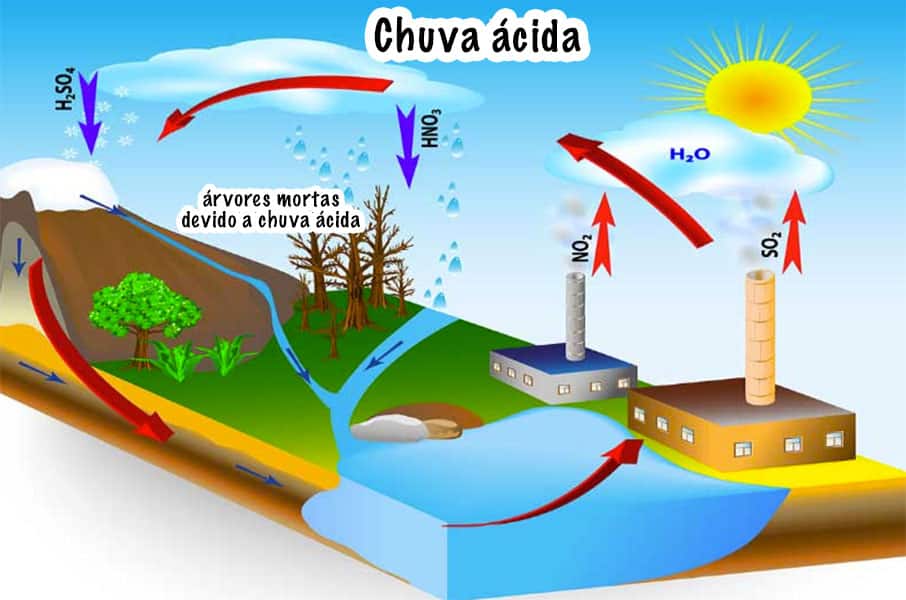
Fonte: Grupo Escolar
Enfim, o que você achou dessa matéria? Aproveite para conhecer mais sobre o ácido clorídrico.
Fontes: Brasil Escola, InfoEscola, Mundo Educação
Fonte Imagem Destaque: Manual da Química



