A corrosão de metais é um fenômeno da eletroquímica, onde ocorre a oxidação do metal, ou seja, uma destruição muitas vezes indesejada. Isso acontece devido a uma reação chamada oxirredução e o metal que mais sofre com essa ação é o ferro. Você com certeza já deve ter visto algo parecido, aquela camada laranjada, também chamamos de ferrugem.
Este processo natural de corrosão advém de grandes concentrações de reagentes e não ocorre, portanto, sem a presença de água e oxigênio. Ante de tudo, se pararmos para pensar, podemos notar que a oxidação pode gerar grandes prejuízos para as fabricações que dependem do ferro em sua estrutura.
Mas, um exemplo mais próximo, é quando deixamos a palha de aço, de lavar louça, muito tempo na água. Pode fazer a experiência: logo ela se oxida e toma aquela textura envelhecida obrigando-nos a fazer o descarte.
Como ocorre a corrosão

Pensando um pouco mais no processo químico da oxidação, pode-se afirmar que a ferrugem é a perda de elétrons para o oxigênio presente no ar. Os locais que mais sofrem com isso são as cidades do litoral, pois a umidade a beira mar é muito maior.
Os metais, em peso, sofrem essa violenta transformação, mas há exceções como a prata e o ouro. A prata ainda consegue ser afetada pela oxidação, entretanto, de uma forma diferente. Você já viu aquela camada preta que fica sobre ela? Pois é! Essa coloração ocorre porque o metal, além de entrar em contato com o oxigênio, também absorve o enxofre.
Mas, o que isso significa na oxidação? Resposta: o metal deve apresentar um potencial de redução, ou seja, deve ter elétrons disponíveis para perder. Esta potência é representada pela sigla “Ered”. Ela é ainda mais forte, porque com a presença da água a formação de íons é mais intensa, o que ajuda no transporte dos elétrons.
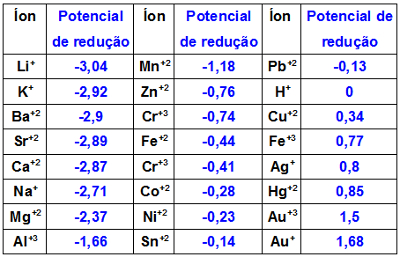
Potenciais de redução ou de oxidação de todos eles
Para compreender melhor, é necessário ter uma base do potencial de redução e oxidação de cada metal presente na tabela periódica. Abaixo é possível encontrar esses valore. Guarde bem essas informações!
Fonte: Manual da Química
Formas de corrosão

Em relação a aparência e a morfologia dos metais, há diferentes formas de corrosões. Listamos o seguintes exemplos:
- Uniforme: essa forma mais comum atinge a superfície do material em peso. É mais fácil de notar quando ocorre, pois sua espessura é alterada, mas pode ser protegida ;
- Corrosão por placas: acontece em partes e é bem progressiva, pois pedaços da superfície vai se soltando e forma depressões;
- Alveolar: similar a anterior essa também sofre escavações, mas sua aparência é arredondada, diferente da corrosão por placas, pois é mais picada abrindo pequenos orifícios na superfície;
- Corrosão por pite: forma super agressiva de corrosão e muito mais difícil de identificar, pois ela ocorre por debaixo, ou seja, é bem mais profunda e não nos dá uma dimensão real de sua gravidade, só pode ser diagnosticada por profissionais;
- Intergranular ou intercristalina: esse acontece entre os grãos da rede cristalina e se dá a corrosão devido aos contornos que se tonar bastante reativos;
- Transgranular ou transcristalina: ao contrário da anterior, ocorre dentro da rede cristalina gerando trica e ficando mais sensíveis e quebradiças.
Métodos de proteção

A princípio, a melhor saída para fugir dessa situação é cuidar para que a oxidação não acontece. São muitos os objetos existentes que são feitos de metal. Para construção civil esses cuidados são redobrados. Mas, há formas de proteção e podem ser feitas da forma mais simples possível.
Por exemplo, a pintura é uma forma de combater a ferrugem. Ou seja, uma simples camada de tinta ajuda. Este método é usado em vários objetos como armário, carro, avião, portão entre outros.
A plastificação, portanto, é outro método usado para proteger o metal das ações exteriores impedindo o contado com a água e o ar. Basta revestir de polímero orgânico mais grosso e seu objeto estará bem resguardado. Esse modo é muito utilizado em tanques de água e gasolina.
Por fim, leia também sobre Transformações Químicas – o que são, como acontecem, tipos, exemplos
Fonte: Manual da química, Brasil escola, ICZ, Infoescola. TSAmbiental, Engenheiro de Materiais, Cola da Web, Química de Graça, Mundo e Educação.
Imagem de destaque: TSA