A isomeria é o nome do fenômeno que ocorre quando duas ou mais substâncias diferentes têm a mesma fórmula molecular, mas com diferentes propriedades e fórmulas estruturais.
Em outras palavras, isomeria é quando substâncias com propriedades e fórmulas estruturais diferentes, têm a mesma fórmula molecular. Sendo assim, diz-se que essas substâncias são isômeras entre si.
A palavra “isômero” vem do grego isos, que significa “igual” ou “mesmo” e meros, que é “parte”. Portanto, isomeria significa “partes iguais”. Sendo que esse termo foi criado pelo cientista Jöns Jacob Berzelius (1779–1848).
Por exemplo, o etanol e o metoximetano são compostos diferentes, contudo, eles têm a mesma fórmula molecular: C2H6O.
Neste caso, o que os diferencia é o fato de que a disposição dos átomos dos elementos em cada composto é diferente.
Enfim, a isomeria é bem comum na química orgânica, já que os compostos feitos de carbono podem se agrupar de várias formas diferentes.
Por exemplo, os 20 carbonos da fórmula molecular C20H42 podem se agrupar de modo a formar 366.319 compostos diferentes.
Isomeria plana e constitucional
Na isomeria plana ou constitucional, a estrutura molecular das substâncias orgânicas é plana. Dessa forma, os compostos com essa característica, recebem o nome de: isômeros planos. Desse modo, temos:
1- Plana de função
A isomeria de função acontece quando dois ou mais compostos têm funções químicas diferentes e a mesma fórmula molecular.
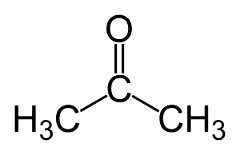
Sendo que isso é bem comum nos aldeídos e cetonas. Por exemplo a cetona propanona C3H6O:
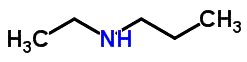
2- Plana de cadeia
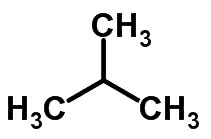
Esse tipo de isomeria ocorre quando os átomos de carbono apresentam cadeias diferentes e a mesma função química. Um exemplo disso, é a estrutura molecular do metilpropano C4H10
3- Plana de posição
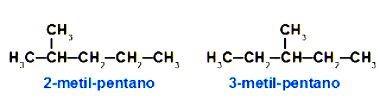
A isomeria de posição acontece quando os compostos se diferenciam pelas várias posições de insaturação, ramificação ou grupo funcional na cadeia carbônica.
Além disso, os isômeros têm a mesma função química. Exemplos disso são:
4- Tautomeria
Também chamada de isomeria dinâmica, este tipo pode ser considerado um caso específico de isomeria de função.
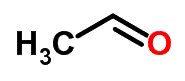
Sendo que, o isômero pode se transformar em outro pela mudança de posição de um elemento na cadeia. Enfim, um exemplo desse tipo de isomeria, é a estrutura molecular de etenol C2H4O:
5- Metameria
Por fim, a isomeria de compensação, também chamada de metameria, ocorre em compostos com a mesma função química que se diferenciam pela posição dos heteroátomos.
Por exemplo, a estrutura molecular de metil-butilamina C5H13N:
Isomeria espacial ou estereoisomeria
A isomeria espacial é uma área da isomeria que analisa as posições dos ligamentos de um isômero no plano espacial.
Dessa forma, podemos ter duas moléculas da mesma substância, mas com ligantes em posições diferentes no espaço. Sendo assim, existem dois tipos de isomeria espacial:
1- Geométrica
A isomeria geométrica é também chamada de cis-trans. Em resumo, ela ocorre em cadeias abertas insaturadas e em compostos cíclicos. Para isso, os ligantes do carbono têm de ser diferentes.
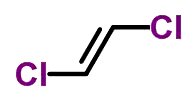
Por exemplo, a forma molecular de trans-dicloroeteno C2H2Cl2
Um detalhe importante é que quando os mesmos ligantes estão do mesmo lado, a nomenclatura do isômero recebe o prefixo cis.
Por outro lado, quando os mesmos ligantes estão em lados opostos, a nomenclatura recebe o prefixo trans.
No entanto, a IUPAC – União Internacional de Química Pura e Aplicada recomenda que em vez de cis e trans, sejam utilizadas as letras Z e E como prefixo.
Isso porque, Z é a primeira letra da palavra alemã zusammen, que significa “juntos”. Em contrapartida, a letra E é a primeira letra da palavra alemã entegegen, que significa “opostos”.
2- Isomeria óptica
Por fim, temos a isomeria óptica, que é demonstrada pelos compostos que são opticamente ativos. Em síntese, ela ocorre quando uma substância é provocada pelo desvio angular no plano de luz polarizada.
Sendo assim, quando uma substância desvia a luz óptica para a direita, ela é chamada de dextrogira. Já quando uma substância desvia a luz óptica para a esquerda, ela é denominada de levogira.
Além disso, uma substância pode existir em duas formas que são opticamente ativas: dextogira e levogira. Nesse caso, o seu nome é: enantiômero.
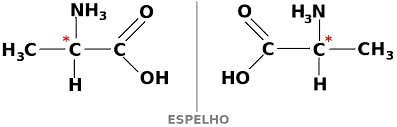
Vale destacar que para que um composto de carbono seja opticamente ativo, ele deve ser quiral. Ou seja, seus ligantes não podem se sobrepor, sendo assimétricos. Por exemplo:
Contudo, se um composto apresenta as formas dextrogira e levogira em partes iguais, elas recebem o nome de misturas racêmicas. Sendo que a atividade óptica das misturas racêmicas é inativa.
Fontes: Toda matéria, Brasil escola e Mundo educação.